Indium ist ein glänzendes silbernes Metall, das so weich und formbar ist, dass es mit einem Fingernagel zerkratzt und in nahezu jede Form gebogen werden kann. In der Natur ist Indium ziemlich selten und kommt fast immer als Spurenelement in anderen Mineralien - insbesondere in Zink und Blei - vor, aus denen es typischerweise als Nebenprodukt gewonnen wird. Die geschätzte Häufigkeit in der Erdkruste beträgt 0,1 ppm (parts per million) - etwas häufiger als Silber oder Quecksilber, so die Royal Society of Chemistry.
Indium hat einen niedrigen Schmelzpunkt für ein Metall: 156,6 Grad Celsius. Bei Temperaturen über dieser Temperatur brennt es mit einer violetten oder indigofarbenen Flamme. Der Name von Indium leitet sich von dem brillanten Indigolicht ab, das es in einem Spektroskop zeigt.
Nur die Fakten
- Ordnungszahl (Anzahl der Protonen im Kern): 49
- Atomsymbol (im Periodensystem der Elemente): In
- Atomgewicht (durchschnittliche Masse des Atoms): 114.8.8
- Dichte: 7,31 Gramm pro Kubikzentimeter
- Phase bei Raumtemperatur: Fest
- Schmelzpunkt: 156,6 ° C (313,88 ° F)
- Siedepunkt: 2,721,6 F (2,072 C)
- Anzahl der Isotope (Atome desselben Elements mit einer unterschiedlichen Anzahl von Neutronen): 35, deren Halbwertszeiten bekannt sind; 1 Stall; 2 natürlich vorkommend
- Häufigstes Isotop: In-115

Entdeckung
Indium wurde 1863 vom deutschen Chemiker Ferdinand Reich an der Freiberg School of Mines in Deutschland entdeckt. Reich untersuchte eine Probe einer Zinkmineralmischung, von der er glaubte, dass sie das kürzlich entdeckte Element Thallium enthalten könnte. Nachdem er das Erz geröstet hatte, um den größten Teil des Schwefels zu entfernen, trug er Salzsäure auf die restlichen Materialien auf. Dann beobachtete er einen gelblichen Feststoff. Er vermutete, dass dies das Sulfid eines neuen Elements sein könnte, aber da er farbenblind war, bat er den deutschen Chemiker Hieronymous T. Richter, das Spektrum der Probe zu untersuchen. Richter bemerkte eine brillante violettfarbene Linie, die nicht mit der Spektrallinie eines bekannten Elements übereinstimmte.
Gemeinsam isolierten die beiden Wissenschaftler eine Probe des neuen Elements und kündigten seine Entdeckung an. Sie benannten das neue Element Indium nach dem lateinischen Wort indicum, was violett bedeutet. Leider wurde ihre Beziehung sauer, als Reich erfuhr, dass Richter laut der Royal Society of Chemistry (RSC) behauptet hatte, der Entdecker zu sein.
Verwendet
Mehr als ein Jahrhundert nach der Entdeckung von Indium lag das Element immer noch in relativer Dunkelheit, da niemand wusste, was er damit anfangen sollte. Indium ist heute in Form von Indiumzinnoxid (ITO) für die Weltwirtschaft von entscheidender Bedeutung. Dies liegt daran, dass ITO nach wie vor das beste Material ist, um den wachsenden Bedarf an LCDs (Flüssigkristallanzeigen) in Touchscreens, Flachbildfernsehern und Sonnenkollektoren zu decken.
ITO verfügt über mehrere Eigenschaften, die es perfekt für LCD-Bildschirme und andere Flachbildschirme machen: Es ist transparent; leitet Strom; haftet stark auf Glas; widersteht Korrosion; und ist chemisch und mechanisch stabil.
ITO wird auch häufig zur Herstellung dünner Beschichtungen für Glas und Spiegel verwendet. Wenn ITO beispielsweise über die Windschutzscheiben von Flugzeugen oder Autos aufgetragen wird, kann das Glas enteisen oder beschlagen, und es kann die Anforderungen an die Klimaanlage verringern.
Die wachsende Nachfrage nach LCDs hat laut RSC die Preise für Indium in den letzten Jahren erheblich erhöht. Recycling und Produktionseffizienz haben jedoch dazu beigetragen, ein ausgewogenes Verhältnis zwischen Angebot und Nachfrage herzustellen.
Indium wird üblicherweise zur Herstellung von Legierungen verwendet und wird oft als "Metallvitamin" bezeichnet, was bedeutet, dass winzige Mengen an Indium laut RSC einen drastischen Unterschied in einer Legierung bewirken können. Zum Beispiel macht das Hinzufügen kleiner Mengen Indium zu Gold- und Platinlegierungen diese viel schwieriger. Indiumlegierungen werden verwendet, um die Lager von Hochgeschwindigkeitsmotoren und anderen Metalloberflächen zu beschichten. Die niedrigschmelzenden Legierungen werden auch in Sprinklerköpfen, Brandschutztürverbindungen und Schmelzsicherungen verwendet.
Indiummetall bleibt bei sehr niedrigen Temperaturen ungewöhnlich weich und formbar und eignet sich daher perfekt für Werkzeuge, die unter extrem kalten Bedingungen benötigt werden, wie z. B. Kryopumpen und Hochvakuumsysteme. Eine weitere einzigartige Eigenschaft ist die Klebrigkeit, die es als Lot sehr nützlich macht.
Indium wird zur Herstellung verschiedener elektrischer Geräte wie Gleichrichter (Geräte, die Wechselstrom in Gleichstrom umwandeln), Thermistoren (ein temperaturabhängiger elektrischer Widerstand) und Fotoleiter (Geräte, die ihre elektrische Leitfähigkeit erhöhen, wenn sie Licht ausgesetzt werden) verwendet.
Quelle & Fülle
Indium kommt in der Natur selten unkombiniert vor und kommt typischerweise in Zink-, Eisen-, Blei- und Kupfererzen vor. Es ist das 61. häufigste Element in der Erdkruste und laut US Geological Survey (USGS) etwa dreimal häufiger als Silber oder Quecksilber. Es wird geschätzt, dass es ungefähr 0,1 ppm in der Erdkruste ausmacht. Nach Angaben von Chemicool wird Indium nach Gewicht auf 250 Teile pro Milliarde (ppb) geschätzt. Natürliches Indium ist laut Encyclopaedia Britannica eine Mischung der Isotope I-115 (95,72 Prozent) und I-113 (4,28 Prozent).
Das meiste kommerzielle Indium stammt aus Kanada und liegt bei 75 Tonnen pro Jahr. Die Metallreserven werden auf über 1.500 Tonnen geschätzt. Kulturböden sind laut Lenntech manchmal indiumreicher als nicht kultivierte Böden mit einem Gehalt von bis zu 4 ppm.
Wer wusste?
- Indiummetall stößt beim Biegen einen hohen "Schrei" aus. Ähnlich wie beim "Blechschrei" klingt dieser Schrei eher wie ein Knistern.
- Indium ist Gallium insofern ähnlich, als es Glas leicht benetzt und zur Herstellung niedrigschmelzender Legierungen sehr nützlich ist. Eine Legierung, die aus 24 Prozent Indium und 76 Prozent Gallium besteht, ist bei Raumtemperatur flüssig.
- Die erste großtechnische Indiumanwendung war laut USGS eine Beschichtung für Lager in Hochleistungsflugmotoren im Zweiten Weltkrieg.
- Laut Lenntech wurden in einer Region Russlands Proben von nicht kombiniertem Indiummetall gefunden.
Bessere Batterien
Laut einer in der Zeitschrift Angewandte Chemie veröffentlichten Studie könnte eine Indiumbeschichtung eines Tages zu leistungsstärkeren und langlebigeren wiederaufladbaren Lithiumbatterien führen. Die Indiumbeschichtung würde eine gleichmäßigere Abscheidung von Lithium während des Ladens bieten, negative Nebenreaktionen puffern und die Lagerung erhöhen.
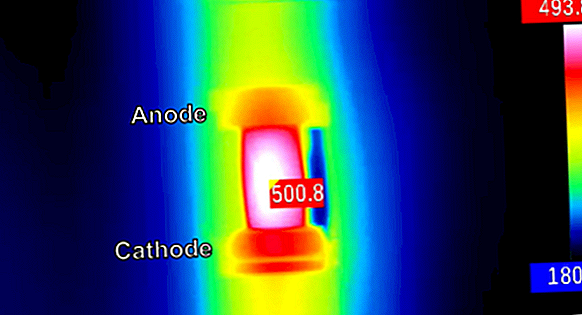
Eine Lithium-Ionen-Batterie ist eine Art wiederaufladbarer Batterie, die üblicherweise in tragbaren Technologien wie Mobiltelefonen und Laptops verwendet wird. Während der Entladung bewegen sich die Lithiumionen von der negativen Elektrode (Anode) zur positiven Elektrode (Kathode). Während die Batterie geladen wird, bewegen sich die Lithiumionen in die entgegengesetzte Richtung - die negative Elektrode wird zur Kathode und die positive Elektrode wird zur Anode.
Derzeit verwenden Lithium-Ionen-Batterien Anoden aus Graphit, mit denen Lithium gespeichert wird, wenn die Batterie aufgeladen wird. Eine vielversprechende Alternative zur Verwendung von Graphit wären metallische Anoden - wie Lithiummetall -, die eine viel größere Speicherkapazität bieten könnten. Ein Hauptproblem bei der Verwendung von Metallanoden besteht jedoch darin, dass sich das Metall während des Ladevorgangs ungleichmäßig ablagert. Dies führt zur Bildung von Dendriten (einer Kristallmasse mit einer verzweigten baumartigen Struktur). Nach längerem Gebrauch werden diese Dendriten so groß, dass sie die Batterie kurzschließen.
Ein weiteres Problem bei metallischen Anoden besteht darin, dass sie unerwünschte Nebenreaktionen zwischen den reaktiven Metallelektroden und dem Elektrolyten verursachen (dem Material, das den Stromfluss zwischen positiven und negativen Elektroden ermöglicht). Diese Reaktionen können die Lebensdauer der Batterie erheblich verkürzen.
Forscher des Rensselaer Polytechnic Institute und der Cornell University haben eine neue Alternative vorgestellt: die Beschichtung des Lithiums mit einer Indiumsalzlösung. Die Indiumschicht ist gleichmäßig und selbstheilend, wenn die Elektrode verwendet wird. Seine chemische Zusammensetzung bleibt gleich und er bleibt während der Lade- / Entladezyklen intakt, wodurch Nebenreaktionen verhindert werden. Dies geht aus der Pressemitteilung der Studie in Science Daily hervor. Dendriten werden ebenfalls eliminiert, wodurch die Oberfläche glatt und kompakt bleibt.